حسن محمود محيسن
قسم الكيمياء || كلية العلوم والآداب بشرورة || جامعة نجران || شرورة || المملكة العربية السعودية
أولاً/ المقدمة:
تُعّرف الكيمياء الكيميائية النباتية، بالمعنى الحرفي للكلمة: ((بأنها المواد الكيميائية التي تنتجها النباتات)). ومع ذلك، يستخدم هذا المصطلح عادة لوصف المواد الكيميائية من النباتات؛ والتي قد تؤثر في الصحة؛ ولكنها ليست المواد الغذائية الأساسية. في حين أن هناك دلائل كثيرة تدعّم الفوائد الصحية لتناول وجبات غذائية غنية بالفواكه والخضراوات، والبقول والحبوب الكاملة والمكسرات والمشروبات ذات الأصل النباتي مثل الشاي والنبيذ؛ دليل على أن هذه التأثيرات (الوقاية من الكثير من الأمراض المزمنة) هي نتيجة لمواد غذائية محددة أو لمواد كيميائية نباتية محدودة؛ لأن الأطعمة ذات الأصل النباتي هي مزيج معقد من المركبات النشطة بيولوجياً، وكذلك ترتبط المعلومات حول التأثيرات الصحية المحتملة للمركبات الكيميائية في النبات مع المعلومات المتعلقة بالآثار الصحية من الأطعمة التي تحتوي على تلك المواد الكيميائية النباتية1.
مشكلة البحث:
تكمن مشكلة البحث في تحديد المقصود بالفلافونويدات، وهل تعد جزءاً من الكيمياء النباتية ولها نشاط استروجيني أم لا، كذلك يتوخى البحث تحديد كون الفلافونويدات من المركبات المضادة للأورام وهل تعد مركبا كيميائياً نشط بيولوجي، وما حدود هذا النشاط أن وجد، ومَا أثارها على الصحة البشرية؟.
ثانياً: الفلافونويدات:
1) مفهوم الفلافونويدات:
الفلافونويدات هي عبارة: ((عن مركبات فينولية متعددة ذات وزن جزيئي منخفض))2- 3 موجودة بشكل مطلق في النباتات، ((ولها نشاط بيولوجيّ))4 ((وكذلك دور حيويّ في خلايا التخليق (التركيب الضوئي)))5.
2) وجود الفلافونويدات:
وتنتشر الفلافونويدات بشكل واسع في المملكة النباتية5، وتوجد الفلافونويدات في الخضروات والفواكه، والمكسرات، والبذور الجذعية، والزهور، والشاي، والنبيذ الخ، وعادة ما تنقسم إلى ست فئات بما في ذلك مركبات الفلافونول، مركبات فلافون، مركبات فلافونون، مركبات 3- فلافانون، مركبات أنثوسيانيدين، مركبات أيسوفلافون. وهي جزء لا يتجزأ من غذائنا اليوميّ6,1. ويقدر الاستهلاك اليومي من الفلافونويدات بـ 1- 2 غ / يوم2. في حين قدّر معدل الاستهلاك من فلافونولات والفلافونات، بـ23 ملغ / يوم ويتوسطها، فلافونول والكويرسيتين بمعدل 16ملغ/ يوم3 ويبيّن جدول- 1 مختلف أنواع الفلافونويدات الموجودة في مصادر غذاء حياتنا اليومية7,1.
جدول (1) الفلافونويدات وشيوعها في النظام الغذائي للإنسان.
| الفرع الرئيس للفلافونيد | المصدر الغذائي | ممثل الفلافونويدات |
| فلافونولات | البصل، اللفت، القرنبيط التفاح، الكرز، الطماطم، التوت، الشاي، والنبيذ الأحمر |
كامبفيرول،
ميريستين، كيرسيتين، و روتين |
| فلافونات | الكرفس، البقدونس، الزعتر، والفلفل الأحمر | أبيجينين، شريسين، وليوتيولين |
| فلافونونات | الحمضيات والخوخ | هيسبيريتين، إيروديكتيول، ونارينجين |
| 3- فلافانولات | التفاح، الشاي، والكاكاو | كاتشين، جالوكاتشين، وإبيكاتشينات |
| أنثوسيانيدينات | الكرز والعنب | سيانيد، ديلفينيدين، مالفدين، وبيونيدين |
| أيسوفلافونات | فول الصويا، البقوليات | جينستين، جلايستين، وفورمانانتين |
3) تركيبة الفلافونويدات:
وتتكون الفلافونويدات من خمس عشرة ذرة كربون اساسية (ست ذرات كربون- ثلاث ذرات كربون- ست ذرات كربون)، والتركيبة الأساس لللفلافونويد هي نواة 2- فينيل بنزو- جاما- بيرون والتي تتكون من حلقتي بنزين (A وB) ترتبط من خلال حلقة بيرانية غير المتجانسة (C)5، كما هو موضّح في الشكل- 1.
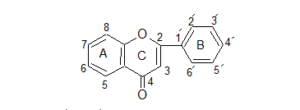
شكل- 1: 2- فينيل بنزو- γ- بيرون (فلافون)
بعض الفلافونات والفلافونولات المهمة الشائعة تمت وضعها في جدول- 2:
جدول(2) الاسم الشائع والاسم الكيميائي لبعض الفلافونات والفلافونولات
|
فلافونات
فلافونولات |
الاسم الشائع | الاسم الكيميائي |
| فلافون
كريسين ابيجينين لوتيولين
فلافونول جلانجين كامفيرور كويرسيتين ميريستين |
2- فينيل- بنزو- γ– بيرون
7،5- ثنائي هيدروكسي فلافون 7،5، 4َ- ثلاثي هيدروكسي فلافون 7،5، 3َ، 4َ- رباعي هيدروكسي فلافون
3- هيدركسي فلافون 7،5- ثنائي هيدروكسي فلافونول 7،5، 4َ- ثلاثي هيدروكسي فلافونول 7،5، 3َ، 4َ- رباعي هيدروكسي فلافونول 7،5، 3َ، 4َ، 5َ- خماسي هيدروكسي فلافونول |
ثالثاً: الفلافونويدات والنشاط الأوستروجيني:
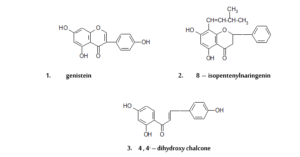
تعد الأيسوفلافونات من المجموعات الرئيسية في الفلافونويدات والتي تتميز بنشاطـاتها ألاوستروجينية، وعلى سبيل المثال، جينيستين (ينتمي الى مجموعة الأيسوفلافونات) (مركب- 1). وهذا يستنتج من الإدراك المبكر بأن مرض حمية النعجة في أستراليا كان سببه مكونات الايسوفلافون لنبات البرسيم الموجـودة في مراعيهـا، وفي البحث الحديـث تم عزل أوستـروجين نبـاتي جديـد9، 8- ايسوبنتينيل نارينجينين(مركب- 2)، من خام عقار تايلاندي المستخرج من لب سيقان نبات Anaxagorea lutzonensis. وفي اختباره خارج الجسم وجد أن هذا الفلافانون يحتوي على أوستروجين (هرمون مثير للدورة النزرية) ذي فعالية مضادة أكثر من جينيستين كما أن وجود مجموعة 8- ايسوبنتينيل (CH3– CH(CH3)- CH=CH- ) عامل مهم لربط أوستروجين المستقبل. ومركبات فلافونات مثل، فلافانونات وفلافونولات مع مجموعة ايسوبنتينيل عند كربون- 8 أظهرت أيضاً انجذابا كبيراً للأستروجين المستقبل في حين 8- أيسوبنتينيل أيسوفلافونات لم يكن نشيطاً، مع العلم أن انتقال مجموعة أيسوبنتينيل من كربون- 8 إلى كربون- 6 أدى إلى فقدان نشاطها، ولكن لم يكن هناك أي اختلاف في النشاط بين تماثل الصور اليميني والشمالي لـ 8- أيسوبنتينيل نارينجينين، وفي اختبار كل من أيسوبنتينيل نارينجينين (30ملليجرام/كيلوجرام/ يوم) وأوستروجين (0.01 ملليجرام/كيلوجرام/يوم) وجد أنهم يوقفون الزيادة في الإفراز البولي في الجسد الممتص لها (هيدروكسي- برولين (Hydroxyproline)، بيريدينولين(Pyridinoline) وديوكسيبيريدينولين (Dexopyridoline)) كما يعملون على تقليل الكثافة المعدنية في الجسم والذي يسببه استئصال المبيض عندما يعطى تحت الجلد لمدة أسبوعين10. في عام 1993، أثبت الباحث ميكسيسيك (Miksicek) أن العديد من مركبات الفلافونويد تمتلك أنشطة أوستروجينية أكثر من السابقة11، وربما أنهم أقل فعالية من 17- بيتا- استراديول (17- β- estradiol)، ولكنه يظهر فعالية عقاقيرية، عند التراكيز الأمثل، والتي تتكافأ مع الهرمون الطبيعي. كل الفلافونويدات الفعالة تحتوي على هيدروكسيلات تأخذ موقع 7 و4َ في نواة فلافون أو 4،4َ لجزيء شالكون، كل من أبيجينين و4،4َ- ثنائي هيدروكسي شالكون (مركب- 3) أظهرا نشاطاً مشابها لـ17- بيتا- استراديول عندما اختبرت مقدرتهم لتحفيز تكاثر خلايا أوستروجين المتوقفة على الخلايا الورمية في صدر الإنسان. ووجود مثل هذه الفلافونويدات في الغذاء الطبيعي للإنسان عادةً يعد غير ضار بسب عدم تواجد أي أوستروجين نباتي في كمية كافية من الطعام للحصول على نتيجة فسيولوجية منطقية. ومع ذلك، فإن هذا ربما لا يمكن تطبيقه على الأشخاص المقتصرين في طعامهم على الخضر والحبوب والفاكهة، وخاصة الذين يتناولون البقوليات في طعامهم التي تحتوي على نسبة عالية من أيسوفلافونويد، مثل فول الصويا والحبوب. وفي الواقع فإن إضـافة مطولة لغـذاء 25 امرأة من ذوات سن اليـأس (سن انقطاع الطمث بين 45- 50) ليس لديهن أي أعراض مرضية من فول الصويا وبزر الكتان وبرعم البرسيم الأحمر وجد أن له تأثير أوستروجيني ملحوظ على نضج مهبلي وعلى قوة الجريب (كيس أو تجويف صغير) المثير للهرمون12.
رابعاً: مفعول الفلافونويدات المضادة للأورام عن طريق تسمم الخلايا:
يوجد العديد من الأبحاث الإحيائية لمعالجة عوامل السرطان بالنباتات، وخصوصاً تلك المعرفة والمستخدمة في الطب الشعبي، وأدى ذلك إلى عزل ومعرفة عدد كافٍ من كل أنواع الفلافونويدات ذات المكونات الفعالة، مثلاً كاتشينات، فلافانات، شالكونات، فلافانونات، فلافونات، فلافونويدات ثنائية وفلافونولات. على أي حال، فإن اختيار عدد من خطوط الخلايا المستخدمة في الاختبارات الإحيائية كانت متنوعة. وهنا سوف نعطي فقط أمثلة للمقارنة الحديثة بين كل أنواع الفلافونويدات المختلفة.
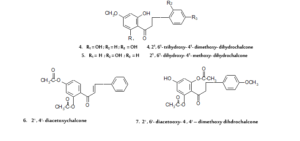
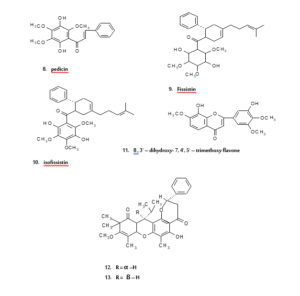
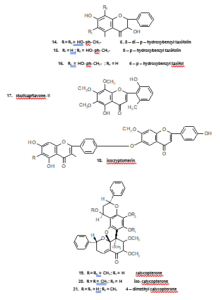
في البحث عن المكونات السامة للخلايا في الأجزاء الهوائية لنبات البصل فصيلة القرني أو البقلي13، وجد أن4،2َ،6َ- ثلاثي هيدروكسي- 4َ- ميثوكسي ثنائي هيدروشالكون (مركب- 4)، 2َ،6َ- ثنائي هيدروكسي- 4َ- ميثوكسي ثنائي هيدروشالكون(مركب- 5) و2َ،4َ- ثنائي اسيتوكسي شالكون (مركب- 6) لها فعاليات نشطة حديثة ضد سرطان الدم وسرطان خلايا الرئوية غير الصغيرة وسرطان القولون. وعلى أي حال، فالمركب الأقوى والفعال كان 2َ،6َ- ثنائي اسيتوكسي- 4،4َ- ثنائي ميثوكسي ثنائي هيدروشالكون (مركب- 7)، اذ لوحظ أن له فعالية مختارة لخطوط خلية سرطان الدم. حيث تم عزل شالكون وبيديسـين (2َ،5َ- ثنائــي هيدروكسي- 3َ،4َ،6َ- ثلاثي ميثوكسي شالكون) (مركب- 8) من أوراق نبات14 Fissistigma languinosum. ومن نفس النبتة تم عزل مركبين جديدين من الشالكونات هما: فيسستين (مركب- 9) وأيسوفيسستين (مركب- 10) حيث أوضحا السمية مضاد لخلايا كب ((KB (خط الخلية المستمدة من سرطان الإنسان من الباعوم الانفي، وتستخدم كمقايسة لعامل مضاد الأورام. وقد تم الابلاغ عن خلايا كب لاحتوائها فيروس الورم الحليمي البشري(. وقد تم عزل اثنا عشر مركبا من مركبات الفلافونويدات السامة للخلايا، سبعة فلافانات، ثلاثة فلافونات واثنان فلافانات ثنائية، من جذور15 Muntingia calabura. وعلى سبيل المثال،8،3َ- ثنائي هيدروكسي- 7،4َ،5َ- ثلاثي ميثوكسي فلافون (مركب- 11) حيث أظهر فعالية أكثر ضد خلايا سرطان الدم من الفلافونات المماثلة. وفي عام 1997 قام الباحث سيو (Seo) وآخرون بعزل سلسلة من مشتقات برينيل غير المألوفة والمعزولة من نبات16 Monotes engleri والتي تعد من الأمثلة على الفلافانونات السامة للخلايا، والتي بدورها أظهرت فعالية قوية ضد صفيحة خطوط خلايا الإنسان (panel of human cell). وعلى سبيل المثال، مركب 6،8- ثنائي برينيل اريوديكتيول (6,8- Diprenyleriodictyol) ومركب هيرافانون (Hiravanone) (6،8- ثنائي برينيل- 3َ- مثيل أريوديكتيول)، كلاهما يحتوي على سلسلتين جانبيتين من برينيل، ووجد أن لهما فعالية قوية ضد صفيحة خطوط خلايا الإنسان أقوى من أي مركب أخر له 1،2- ثنائي مثيل الليل كمجموعة مستبدلة عند ذرة الكربون السادسة. أما مركب- 12 ومركب- 13، فيعتبران من المركبات الفلافانونات ذو خماسية الحلقة المعزولة من أوراق نبات Baeckea frutescens، حيث تبين أن لهما فعالية سامة قوية ضد خلايا سرطان الدم في عينة النسيـج الانستنباتي البكتيري17. ومـن ساق نبـات Cudrania tricuspidata تم عزل ثلاثة مركبات سامة للخلايا محتوياً على مجموعة بنزيل ثنائي هيدروفلافونات: 6،8- ثنائي- بارا- هيدروكسي بنزيل تكسيفولين18 (مركب- 14) و8- بارا- هيدروكسي بنزيل تكسيفولين (مركب- 15) و6- بارا- هيدروكسي بنزيل تكسيفولين (مركب- 16). وهذه المركبات كانت سامة لخطوط خلايا الإنسان الورمية مثل، الجلد، دم، القولون، والكلوي.
إن العديد من الفلافونات السامة للخلايا تم عزلها من نوع Scutellaria. وأحـد هـذه الاكتشافات المبكرة مركب سكيولكاب فلافون- II (5،2َ- ثنائي هيدروكسي- 6،7،8،6َ- رباعي ميثوكسي فلافون) (مركب- 17) المعزولة من جذور Scutellaria baicalensis، والذي أبدى فعالية ضد خلايا سرطان الدم19. وفي أغلب الدراسات الحديثة لمستخلصات جــذور Scutellaria indica تم التعرف على اثنين من مركبات الفلافونات وثلاثة من مركبات فلافانونات20، ولكن اثنين منهم أظهرا أهمية تجاه الفعاليات السامة وهما: وجونين (Wogonin) (5،7- ثنائي هيدروكسي- 8- ميثوكسي فلافون) و5،2َ،5َ- ثلاثي هيدروكسي- 7،8- ثنائي ميثوكسي فلافون، مع العلم أن المركب الثاني أظهر فعالية أكثر ضد خلايا سرطان الدم.
إن التركيب الكيميائي لهذه الفلافونويدات متشابهة وذلك بأن كلاهما يحتويان على 2َ- هيدروكسيل ولهذا ربما يعدان من المركبات السامة للخلايا. ومن الاكتشافات المبكرة الجديدة في الأبحاث الأحيائيـة أيضاً مركبات الفلافونويدات الثنائية (باي- فلافونويدات)، مثل هينوكيفلافون21، حيث تم عزله من نبات Rhus succedanea سنة 1989. وبمقارنة سمية هينوكيفلافون مع فلافونويدات الثنائية المتقاربة، وجد أن الارتباط 4َ،6 بين جزئيين من أبيجنين يكون أهمية تجاه السمية. وعلى أية حال، مْن بين مركبات فلافونويدات الثنائية الثلاثة السامة المعزولة من نوع Selaginella، واحدة فقط، وهو كريبتوميرين (مركب- 18) تحتوي على هذا الارتباط، أما المركبات الأخرى: 4َ،7ً- ثنائي- O- مثيل أمينتوفلافون و7ً- O- مثيل روبيوستافلافون (7- O- methylrobustaflavone̋)، كانت ذات سمية ضد خطوط خلايا الإنسان متضمنة الثدي، الرئة، سرطان القولون، سرطان البروستات، ورم لحمي ليفي، سرطان الفم الجلدي وسرطان الدم22، وثلاثة فلافانونات ثنائية: كاليكوبتيرون (مركب- 19)، أيسوكاليكوبتيرون (مركب- 20) و4- مثيل كاليكوبتيرون (مركب- 21) و5،5َ- ثنائي هيدروكسي- 3،6،7،3َ رباعي ميثوكسي فلافون (مركب- 22)، عزلت من زهور Calycopteris floribunda أوضحت فعالية سميتها ذات النطاق الواسع ضد صفيحة خطوط خلايا الإنسان23. من بين الفلافونولات، مركب كويرسيتاجيتين- 6،7،3، َ4- رباعي مثيل ايثر (مركب- 23)، المعزول من الجزء الخضري لنبات Artemisia annua وجد أن له فعالية سامة ضد سرطان الدم وسرطان الخلايا الرئوية غير الصغيرة وسرطان القولون والخلايا الاوستروجينية المتوقفة على الخلايا الورمية في صدر الإنسان24.
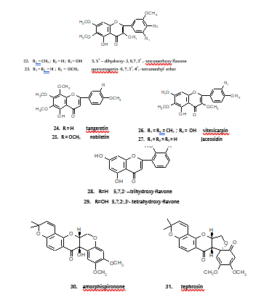
وفي استخلاص البراعم من نبات Platanus orientalis، أغلبية المكونات السامة كانت تحتوي على فلافونول جليكوسيد وكامبفيرول- 3- (2ً،3ً- ثنائي- E- بارا- كويومارويل رامنوسيد) (kaempferol- 3- (2̋,3̋- di- e- p- coumaroyl rhamnoside). كما يوجد أثنان من الفلافونات التي تخضع لعمليات المثلة، تانجريتين (5،6،7،8،4َ- خماسي ميثوكسي فلافون) (مركب- 24) ونوبيليتين (5،6،7،8،3َ،4َ- سداسي ميثوكسي فلافون) (مركب- 25) إذ تثبط من تكاثر الخلايا المحرفشة السرطانية الضمامية (ورم خبيث في الصمام يحتوي على خلايا مغزلية) وفلافون أخر، فيتيكسيكاربين (3،5َ- ثنائي هيدروكسي- 3،6،7،4َ- رباعي ميثوكسي فلافون) (مركب- 26) تم عـزله مـن ثمار Vitex rotundifolia، وجد أن له فعالية تثبيطية ضد تكاثر كريات الدم البيضاء والتي تنتج من الغدة التيموسية وليس ضد كريات الدم البيضاء ذات الوظيفة الدفاعية لإنتاج أجسام مضادة25. كما يوجد أبحاث أخرى تطبيقية على الفلافون البسيط أبيجينين، وتأثيرها الكيميائي على الأورام الجلدية في الفأر. وقد وجد أن أبيجينين مثبط فعال لسرطان اورنيثين بَشرَوِي ((epidermal ornithine، كما أظهر قابليته في تقليل تحويل الورم الحليمي إلى ورم سرطاني26. وفي اختبار السمية لـواحد وعشرين مركبا من مركبات الفلافونويدات المعزولة من نبات نوع Arnica ضد خلية سرطان القولون المستقيمي وضد خلية سرطان الرئة الصغير، الفلافون، جاسوسيدين (5،7،4َ- ثلاثي هيدروكسي- 6،3َ- ثنائي ميثوكسي فلافون) (مركب- 27) وجد أنه يعد من أكثر المكونات سمية27. ويوجد اثنان من الفلافونويدات المعزولة من نبات Scutellaria baicalensis وهمـا: 5،7،2َ- ثلاثي ميثوكسي فلافون (مركب- 28) و5،7،2َ،3َ- رباعي هيدروكسي فلافون (مركب- 29) لهما فعالية تثبيطية قوية ضد الأورام المنشئة28. والروتينويدات المتمثلة في امورسفيسبيرونون (مركب- 30) وتيفروسين (مركب- 31) المعزولة من نبات Amorpha fruticosa أيضاً لها فعالية تثبيطية ضد الأورام المنشئة ومثبط للأورام الجلدية في جسم الفئران29. مركب 3،7- ثنائي ميثوكسي فلافون أظهر فعاليته ضد الاجتياح المعاكس ضد اجتياح اوستروجن التابع لخلية سرطان الثدي الإنسان في أجزاء قلب الجنين عند تركيز يتراوح ما بين 1 إلى 100 ميكرومول.
خمساً: بعض النشاطات البيولوجية الأخرى للفلافونويدات:
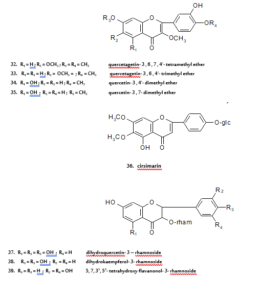
من المعروف أن بعض الفلافونويدات تعمل كمضادات للتقلصات، وذلك عن طريق استرخاء الأمعاء الدقيقة لمختلف الثدييات8. وفي الأبحاث الحديثة على النباتات الطبية المستعملة تقليدياً في أوروبا لعلاج أمراض الجهاز التنفسي، توجد أربعة فلافونولات لها نشاط ضد التقلصات والتي تم استخلاصها من الأجزاء الهوائية لنبات30 Artemisia abrotanum. وهي كويرسيتاجيتين- 3،6،7،4َ- رباعي مثيل أيثر (مركب- 32) و3،6،4َ- ثلاثي مثيل أيثر (مركب- 33) وكويرسيتين- 3،4َ- ثنائي مثيل أيثر (مركب- 34)، حيث تبدي هذه المركبات الثلاثة تأثيراً استرخائياً على القصبة الهوائية في الخنزير الهندي، بينما المركب الرابع، كويرسيتين- 7،3- ثنائي مثيل أيثر (مركب- 35) فهو أقل تأثيراً. وكذلك كويرسيتين- 3- جلوكوسيد وروتين المستخلصان من الأجزاء الهوائية لنبات Conzya filaginoides يحثان على تركيز معتمد لتثبيط الانقباضات التلقائية في الجزء الأخير من الأمعاء الدقيقة للجرذ31. كما تم الاستدلال على أن روتين يحث على استرخاء العضلات الملساء في مختلف الأجزاء الأخرى مثل قولون الخنزير الهندي ومعي الاثنا عشر في الجرذ32.
إن الفلافونويدات تظهر أيضاً نشاطاً ضد البكتريا، فنبات Euphorbia hirta وجد أنه يستعمل لعلاج الإسهال وبعض الأمراض المعدية الأخرى32. حيث قام العالم غالفز(Galvez) وآخرون عام 1933 بإثبات أن المادة الفعالة في نبات Euphorbia hirta هي كويرسيتين- 3- رامنوسيد (كويرسيترين) لها نشاط مضاد للإسهال، وذلك بالتجفيف التام للمادة المستخلصة من كامل النبتة والمستخدمة ضد الإسهال الذي يحدثه زيت الخروع، وحامض أراشيدونك [CH3(CH2)3(CH2CH=CH)4(CH2)3COOH] وبروستاجلاندين- E2 (وهي مجموعة كبيرة من مشتقات الأحماض الدهنية التي لها نطاق واسع من الانتشار البيولوجي ذات طبيعة تنظيمية حيث تعمل كمؤثرات بسيطة في الفعل الهرموني ولكنها لا تعمل كهرمونات كما أنها تعمل على تنظيم والتحكم في عمل ATP). واستعمال نبات Microtea debilis في الطب التقليدي أو الشعبي في علاج وجود البروتين في البول قد تم توضيحه بواسطة تأثير الأدينوسينA1– (أي قاعدة نيتروجينية تدخل في تركيب DNA وجريئة ATP)المضاد باستخدام مركب سيرسيمارين[سكيوتيلارين- 6- 7- ثنائي مثيل أيثر- 4́- جلوكوسيد] (مركب- 36)، وهو الفلافون الرئيسي في نبات33.Microtea debilis
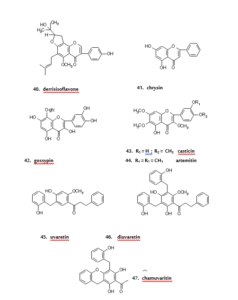
إن العديد من الفلافونويدات أظهرت خاصية التحفيز غير المتوقع كمواد حامية للكبد10، وفي الأبحاث الحديثة التي أجريت على استخلاص الجذمار (ساق أرضية شبيهة بالجذر) لنبات Smilax glabra وجد أنه يحسن بشكل واضح الكبد المتضرر والمسبب للحساسية المفرطة تجاه كلوريد بيكريل وذلك عند إعطائها في مرحلة التأثير وليس في مرحلة التحفيز، وأحد هذه المركبات الفعالة تم التعرف عليها كـ فلافانونول، ثنائي هيدروكويرسيتين- 3- رامنوسيد34 (مركب- 37)، واثنين آخرين من الفلافانونولات، ثنائي هيدروكامبفيرول- 3- رامنوسيد(مركب- 38) و5،7،3َ،5َ- رباعي هيدروكسي فلافانونول- 3- رامنوسيد (مركب- 39)، استخلصت من نفس النبتة، أيضا أظهرت نشاطا في حماية الكبد، ولكن لم تكن المركبات الفينولية نشطة35. وقد تم استخلاص ثلاث أيسوفلافونات، 8،6- ثنائي برينيل جينيستين، 6،3َ- ثنائي برينيل جينيستين وديريس أيسوفلافون)مركب- 4 (من نباتDerris scandens، حيث وجد أنها مضادة للفطريات ضد الكائن الممرض (المسبب للمرض كالجرثوم الخ) عند البشر36. ويوجد العديد من الأعشاب الطبية التي تعطى في حالة القلق أو الخوف. وفي الوقت الحاضر اتضح التأثير المضاد للقلق باستخدام نبات Passiflora coeuleu لوجود فلافون بسيط وهو شريسين37 (7،6- ثنائي هيدروكسي فلافون) (مركب- 41)، والذي يعمل كمطروحات تنافسية للعقار البنزوديازيبين38 (Benzodiazepine). كما اظهر مركب أبيجينين المعزول من زهور نبات Matricaria recutita نفس النشاط في الفأر مع قليل من التأثير المهدئ39. والفلافونويدات مثل جوسبين40(مركب- 42)، أبيكاتشين41، مورين وروتين42 وجد أن لها تأثيراً مسكناً ملحوظاً. وفي الدراسات السابقة، على الفعاليات المسكنة للفلافون المصنع التي تم مقارنتها مع فلافانون43، وكل الفحوصات التي أجريت على فلافونويدات أظهرت تأثيراً مسكناً يعتمد على الجرعة ماعدا فلافانون، والاستبدال في موضع 5- هيدروكسيل قد زاد من تأثير المسكن في الغالب إلى ثمانية أضعاف بينما مجموعة الميثوكسيل في موضع ذرة الكربون- 3 قد قللت من تأثير الفلافون، أما وجود الميثوكسي عند ذرة الكربون- 6 أو ذرة الكربون- 4́ أدت إلى زيادة في التأثير إلى ضعفين ولكن الإحلال عند ذرة الكربون- 7 أو ذرة الكربون- 2́ قللت القوة نسبياً.
وفي الصين يستعمل تقليدياً نبات Artemisia annua للوقاية من الملاريا، حيث تم التعرف على المادة الرئيسية الفعالة كـ سيسكويتربين (Sesquiterpene)، لاكتون وأرتيميسينين (Artemisinin). ولكن في عام 1987 أثبت العالم الفورد (Elford) وآخرون أن الفلافونول، كاستيسين (5،3́- ثنائي هيدروكسي- 3،6، 7، 4́- رباعي ميثوكسي فلافون) (مركب- 43 (، يتواجد في كل أجزاء النبتة Artemisia annua، بينما أرتيميتين (5- هيدروكسي – 3،6، 7، 3́، 4́- خماسي هيدروكسي فلافون) (مركب- 44)، يتواجد في الخلايا المستنبتة (البكتريا أو الأنسجة الحية)وهذا يعزز من نشاط مركب أرتيميسينين ضد الملاريا44. في حين أظهرت تجارب سابقة نفس التأثير باستخدام 5 ميكرومول من كويرسيتاجيتين- 3،6، 7- ثلاثي مثيل إيثر، مع العلم أن هذا التركيز غير سام45. وهذا يوضح أن هناك تأثيرا تعاونيا على الأقل بين بعض الفلافونويدات وأرتيميسينين في هذه النبتة. وفي النباتات الأفريقية الطبية وجد أن مضادات الملاريا مكونة من الفلافونويدات نفسها. وبالتالي، وجد أن المركبات الفعالة في نبات من نوع Uvaria هي: يوفاريتين(مركب- 45) ومشتقاته، داىيوفاريتين (مركب- 46) وشاميوفاريتين46 (مركب- 47).
سادساً: الفلافونويدات والصحة البشرية:
تتواجد الفلافونات في المأكولات والمشروبات النباتية، لذلك فان كميات مهمة منها تستهلك في طعامنا اليومي، وبالتالي فهي مرتبطة مع الطبيعة الغذائية والحسية المتنوعة في طعامنا النباتي. ومنذ عقود اكتشف أن الفلافونات لها نشاطات مضادة للأكسدة في خارج الجسم الحي، ولكن لا يزال غير واضح ما إذا كانت تتواجد لها تأثيرات مفيدة داخل الجسم الحي. كما أن هناك العديد من النشاطات البيولوجية الأخرى للفلافونات تم ذكرها سابقاً، حيث لم يتم التأكد من طبيعة تأثير الفلافونات على الطبيعة البشرية، ولكن بعض التجارب الحديثة أثبتت أن لها تأثيراً كمضادات للأورام.
وفي سنة 1970 افترض أن متوسط ما نستهلكه من الفلافونات الموجودة في الغذاء يقارب 1جم في اليوم47، وهذه الصورة كانت مبحثاً للتساؤل في الفحوصات الحديثة للفلافونات الموجودة في بعض الخضروات والفواكه التي نعتمد عليها في أكلنا48. والقياسات المعتمدة على التحليل الحامضي لمستخلصات النبات الخام كانت في الغالب تحتوي على كميات مختلفة من كويرسيتين وكامبفيرول، وعلى سبيـل المثال، مستوى كويرسيتين في الخضروات المأكولة أقـل من10 ملليجرام/كيلوغرام ماعدا البصل واللفت والبركولى (نوع من القنبيط)والفول السوداني فإنها تحتوي على 486 ملليجرام/كيلوغرام، وفي معظم الفواكه يبلغ مستوى الكويرسيتين إلى 15 ملليجرام/كيلوغرام ماعدا التفاح الذي يحتوي مابين21- 72 ملليجرام/كيلوغرام، وفي الغالب هذه القيم ربما تكون في الجانب الأدنى لأنه قد يكون هناك فقد للفلافونات أثناء التحلل الحامضي. وقد أثبتت التجارب أن الكويرسيتين على وجه التخصيص يخضع لتحليل أكسدي في المحلول الحامضي الساخن.
أما الدراسات المتعلقة لمحتوى الفلافونات في المشروبات الشائعة فتدل على أن عصائر الفواكه تحتوي على أقل من 5 ملليجرام/لتر، ماعدا عصير الليمون فانه يحتوي على 7 ملليجرام/لتر، وعصير الطماطم يحتوي على 13 ملليجرام/لتر. وبالمقارنة مع مشروبات الشاي فان الشاي يحتوي على 50 ملليجرام/لتر من الفلافونات الثلاثة الشائعة.
وعلى ما تقدم أعلاه فان هناك تراكيز عالية من الفلافونات موجودة في الغالب كالجليكوسيدات في الخضروات مثل البصل والفاكهة مثل التفاح، وفي المشروبات مثل الشاي، ولكنها لا تشير بشكل مباشر لتأثير مضاد للسرطان. والدراسات الحديثة الثلاثة للفلافونات في فول الصويا والشاي تشير بشكل مباشر إلى أن الفلافونات الموجودة في الغذاء تستخدم لعلاج الأورام.
وأول دراسة ركزت على جينيستين ألايسوفلافوني وهو أوستروجين نباتي الموجود في فول الصويا، الذي وجد أنه يوقف عمل عامل الاستنساخ الذي يعرف بعامل ككات (CCAAT)، وبذلك فان خلية السرطان تجوع وتموت، حيث يعد جينستين المتواجد غالباً في فول الصويا من الفلافونات التي لها القدرة على إيقاف نمو الأورام وتكوين الأوعية الدموية الجديدة ليس لها أثار ضارة على الخلايا الطبيعية49.
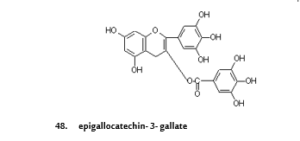
أما الدراستان الأخيرتان فقد اهتمت بالفلافونات الموجودة في الشاي وميزات شرب العديد من أكواب الشاي، كلا الدراستين تجـذب الانتبـاه للتركيز النسبي العالي للكاتشينات(3- فلافونول) وعلى وجه التخصيص إبيجالوكاتشين- 3- جاليت (مركب- 48) والذي يرمز له بـ (EGCG) والمتواجد في الشاي50. فالأورام البشرية تحتاج إلى إنزيمات بروتينية محللة لتهاجم الخلايا، وأحد هذه الأنزيمات إنزيم يوروكيناز (urokinase) حيث لوحظ أن تثبيط هذا الأنزيم يقلل من حجم الورم، وقد يؤدي إلى اختفائه كلياً في الفأر. في الدراسة الاولى، يرتبط مركب EGCG مع إنزيم يوروكيناز بحجب الحمض الاميني هيستيدين وسيرين في موقع الحفاز. وعلى الرغم من ذلك فانه يعد مثبطاً لـلأنزيم يوروكيناز مقارنة بالأدوية المصنوعة مثل إميلوريد(Amiloride)، حيث يستهلك مركب EGCG من قبل البشر بمستويات عالية، وشرب كوب واحد من الشاي يحتوي على 150 جرام من مركب EGCG بينما أقصى جرعة محتملة من دواء إميلوريد تساوي 20 ملليجرام في اليوم. وبذلك فان وجود مركب EGCG في الشاي يعترض النشاط الكيميائي لانزيم يوروكيناز وبذلك يكون من الأغذية المهمة في تقليل الأورام البشرية52- 51 (السرطان).
أما الدراسة الثانية لمركب EGCG فتدل على أنه قادر على تثبيط تكوين الأوعية الدموية الجديدة (العملية الأساسية في نمو الأوعية الدموية اللازمة لنمو الأورام وانتشارها)، لأن نمو كل الأورام يعتمد على تكوين الأوعية الدموية الجديدة وهذه الظاهرة تشرح من جديد أن شرب الشاي مفيد في تجنب ظهور العديد من الأورام البشرية55- 53.
وبناء على ما تقدم اعلاه، فان الشاي يعتبر مصدر غذائي رئيسي للفلافونويدات ويحتوي على نسبة عالية من فلافان- 3- أول كاتشينات في اوراق الشاي الجافة (الأخضر أو الأسود)56. ومع ذلك، فان نتائج التحاليل الوصفية لاستهلاك الشاي لم تنتج أدلة ثابتة على الوقاية من السرطان(الجدول- 3). في حين أن الشاي الأخضر تم توثيق قدرته على انخفاض مخاطر أو الوقاية من مرض السرطان البروستات58- 57، والثدي60- 59، والرئة61، والمبيض63- 62، والكبد64، والمعدة65. كما يوجد دراسات أخرى توضح أنه لا يوجد علاقة بين استهلاك الشاي وخطر سرطان المبيض68- 66، المعدة70- 69، والقولون71، وعلى سبيل المثال، وثقت بعض الدراسات تأثير شرب الشاي (18- 25% = 2 كوب = يوم) على الوقاية من سرطان الرئة61 وسرطان بطانة الرحم72، حيث لوحظ أن استهلاك 5 اكوب من الشاي الأخضر او اكثر يوميا يعمل على الوقاية ضد سرطان المعدة65.
جدول (3) التحاليل الوصفية لتأثيرات الفلافونويدات على مخاطر السرطان.
| نوع الورم | النتيجة | رقم المرجع | |
| البروستات | الشاي الأخضر له تأثير وقائي ضد سرطان البروستات في تجربة واحدة ذات تحكم عشوائي | 57 | |
| امتصاص مركب جينيستين ومركب ديدزين لهما علاقة بانخفاض خطر الاصابة بسرطان البروستات | 73 | ||
| تأثير وقائي للشاي الأخضر وليس للشاي الأسود في السكان الآسيويين | 58 | ||
| ثدي | الحد من مخاطر السرطان الثدي عند النساء الآسيويات وبعد سن اليأس باستخدام الايسوفلافون المعزول من فول الصويا | 74 | |
| زيادة كثافة الثدي عند النساء قبل انقطاع الطمث باستخدام الايسوفلافون المعزول من فول الصويا | 75 | ||
| انخفاض صغير لخطر السرطان مع تناول فول الصويا | 76 | ||
| تقليل خطر السرطان مع زيادة تناول فول الصويا | 77 | ||
| الحد من مخاطر السرطان مع استهلاك الشاي الأخضر | 59 | ||
| الحد من مخاطر السرطان باستهلاك 5 اكواب من الشاي الأخضر | 60 | ||
| رئة | الحد من مخاطر السرطان في بعض السكان | 78 | |
| انخفاض نسبة خطر السرطان الى 18% بزيادة استهلاك الشاي الأخضر (2 كوب يوميا) | 61 | ||
| المبيض | لا علاقة بين استهلاك القهوة والشاي وخطر السرطان في دراسة إبيك | 66 | |
| الشاي الأخضر وتأثيره الوقائي ضد السرطان | 62 | ||
| دور وقائي للشاي الأخضر على سرطان المبيض وسرطان بطانة الرحم | 63 | ||
| لا علاقة بين استهلاك الشاي وخطر الإصابة بسرطان المبيض | 67 | ||
| لا علاقة بين شرب الشاي والقهوة وسرطان المبيض | 68 | ||
| بطانة الرحم | تناول 2 كوب من الشاي الأخضر يؤدي الى خفض نسبة الاصابة بالسرطان الى 25% | 72 | |
| الكبد | تأثير وقائي للشاي الأخضر على الأورام الأولية | 64 | |
|
معدي
|
تناول 5 اكوب من الشاي الأخضر لع مفعول وقائي ضد السرطان. | 65 | |
| لا علاقة بين استهلاك الشاي الأخضر وخطر السرطان | 69 | ||
| القولون
|
لا يوجد ارتباط بين استهلاك الشاي الأخضر والأسود | 71 | |
سابعاً: الخاتمة:
ان الفلافونويدات تؤلّف مجموعة واسعة من المركبات البيولوجية النشطة التي توجد بوفرة في المملكة النباتية والمتناول الغذائي، حيث تؤثر بشكل حاسم على العديد من العمليات المناعية الخلوية المرتبطة بتطور وتقدم السرطان. حيث يوجد الكثير من الأدلة على أن مركبات الفلافونويد لها تأثيرات مهمة على تثبيط التسرطن. لذلك لاقت الفلافونويدات الكثير من الاهتمام في المؤلفات على مدى عشر السنوات الماضية، حيث، أصبحت هذه الفئة من المنتجات الطبيعية موضوع البحث المضاد للعدوى؛ لهذا تم عزل واكتشاف العديد من المجموعات المحتوية على تركيبة الفلافونويدات المضادة للورم. وقد عززت التجارب فكرة أن مركبات الفلافونويد يمكن أن تكون عوامل مفيدة مضادة للسرطان. وتجدر الإشارة إلى أن معظم مجال الأبحاث الفعالة للفلافونويدات في الوقت الحاضر تكمن في إمكانية الإسهام الطبي لجعل الفلافونويدات في خدمة صحة البشرية. وقد نشر عن الممارسات الواسعة للفعالية البيولوجية للفلافونويدات، وهي: المضادة للتقلصات، مضاد للبكتيريا، حماية الكبد، مضاد للفطريات، علاج للملاريا.
شكر وتقدير
لا أجد الكلمات المناسبة للتعبير عن شكري وتقديري للدكتور عمر أحمد باسودان، كلية الصيدلة، جامعة الملك سعود- السعودية، والدكتور عاطف عبد العزيز، كلية العلوم والآداب بشرورة، جامعة نجران- السعودية لمواظبتهما على تقديم العون خلال فترة تحرير البحث وكتابته. كما اشكر جامعة نجران، المملكة العربية السعودية لتقديم الدعم المادي والمعنوي اثناء عمل هذا البحث.
المصادر والمراجع
- Tripoli, E., Guardia, ML., Giammanco, S., Majo, D.D., Giammanco, M., (2007). “Citrus flavonoids: Molecular structure, biological activity and nutritional properties”: A review. Food Chemistry; 104: 466- 479.
- Fernandez, S.P., Wasowski, C., Loscalzo, L.M., Granger, R.E., Johnston, G.A.R., Paladini, A.C, Marder, M., (2006). “Central nervous system depressant action of flavonoid glycosides”. European Journal of Pharmacology; 539: 168- 176.
- Heim, K.E., Tagliaferro, A.R., Bobliya, D.J., (2002). “Flavonoids antioxidants: Chemistry, metabolism and structure- activity relationships”. The Journal of Nutritional Biochemistry; 13: 572- 584.
- Muhaisen, H.M., (2017). “Antimicrobial flavonoids and their role in plant animal interactions”. Arab journal of sciences and research publishing (journal of medicinal and pharmaceutical sciences); Vol.4(1):13- 30.
- محيسن حسن محمود، ” الفلافونونيدات المضادة للميكروبات ودورها في تفاعلات النبات والحيوان”، مجلة العلوم الطبية والصيدلانية، المجلد الاول، العدد الرابع، 13- 30، 2017
- Cushnie, T.P.T., Lamb, A.J., (2005). “Antimicrobial activity of flavonoids”. International Journal Of Antimicrobial Agents; 26: 343- 356.
- Prey, J.O., Brown, J., Fleming, J., Harrison, P.R., (2003).” Effect of dietary flavonoids on major signal transduction pathways in human epithelial cells”. Biochemical Pharmacology; 66: 2075- 2088.
- Ren, W., Qiao, Z., Wang, H., Zhu, L., Zhang, L., (2003).”Flavonoids: Promising Anticancer agents”. Medicinal Research Reviews; 23: 519- 534.
- Hari, K.N., Kesava, V. K. R., Ravikumar, A., Supriya, M., Ram, C., Stanley, A. S..(2004). “Inhibition of Prostate Cancer Cell Colony Formation by the Flavonoid Quercetin Correlates with Modulation of Specific Regulatory Genes”.Clin Diagn Lab Immunol;11(1):63- 9.
- Kitaoka, M., Kdokawa. H., Sugano. M., Ichikawa, k., Taki, M., Takaishi, S,. Lijima, Y., Tsutsumi, S,. Boriboon, M., Akiyama. T., (1998). “Prrenylflavenoids:: Anew class of non- steroidal Phytoesstrogen (part). Isolation of 8- isopentenylnaringenin and an initial study on its structure- activity relationships”. Planta Medica; 64: 511- 515.
- Bolca, S., Wyns, C., Possemiers, S., Depypere, H., De Keukeleire, D., Bracke, M., Verstraete, W., Heyerick, A..(2009). “Cosupplementation of isoflavones, prenylflavonoids, and lignans alters human exposure to phytoestrogen- derived 17beta- estradiol equivalents”.J Nutr.;139(12):2293- 300.
- Sylwia, G., Iwona, S., Iwona, Ł., Artur, G..(2014). “Are naringenin and quercetin useful chemicals in pest- management strategies”. J Pest Sci. ; 87(1): 173–180.
- Wilcox, G., Wahlquist, M.L., Burger, H.G., Medley, G., (1990). “Oestrogenic effects of plant foods in menopausal women”. British Journal of Medicine; 301: 905±906.
- Sak, K..(2014). “Characteristic features of cytotoxic activity of flavonoids on human cervical cancer cells”.Asian Pac J Cancer Prev.;15(19):8007- 19.
- Alias, Y., Awing, K., Hadi, H.A., Thoson, O., Sevenet, T., Pais, M., (1995). “An animitotic and cytototic chalcone from fissistigma lanuginosum”. Journal of Natural Product; 58: 1160- 1166.
- Su, B.N., Jung, P. E., Vigo, J.S., Graham, J.G., Cabieses, F., Fong, H.H., Pezzuto, J.M., Kinghorn, A.D..(2003). “Activity- guided isolation of the chemical constituents of Muntingia calabura using a quinone reductase induction assay”.Phytochemistry;63(3):335- 41.
- Seo, E.K., Silva, G.L., Chai, H.B., Chagwedera, T.E., Farnsworth, N.R., Cordell, G.A., Pezzuto, J.M., Kinghorn, A.D., (1997). “Cytotoxic prenylated flavanones from Monontes engieri”. Phytochemistry; 45: 509- 515.
- Goutam,B..(2015). “Goutam Brahmachari green synthetic approaches for biologically relevant heterocyclic”. Elsevier inc.; 185- 208.
- Lee, I. K., Kim, C. J., Song, k. S., Kim, H. M., Koshino, H., Uramoto, M., Yoo. I. D., (1996). “Cytotoxic benzylflavonols from Cudania tricuspidata”. Phytochemistry; 41: 213- 216.
- Li, C., Lin ,G., Zuo, Z..(2011). “Pharmacological effects and pharmacokinetics properties of Radix Scutellariae and its bioactive flavones”.Biopharm Drug Dispos;32(8):427- 45.
- Kowalczyk, E., Krzesiński, P., Kura, M., Niedworok, J., Kowalski, J., Błaszczyk, J..(2006). “Pharmacological effects of flavonoids from Scutellaria baicalensis”.Przegl Lek;63(2):95- 6.
- Lin, L.C., Kuo, Y.C., Chou, C.J..(2000). “Cytotoxic biflavonoids from Selaginella delicatula”. Nat. Prod.;63(5):627- 30.
- Lin, L.C., Kuo, Y.C., Chou, C.J..(2000). “Cytotoxic biflavonoids from Selaginella delicatula”. Journal of Natural products; 63(5):627- 30.
- Sreekanth, P., Narayana, K., Shridhar, N.B., Bhat, A.,(2006). “Toxicity studies of Calycopteris floribunda Lam. in calf, rabbit and rat”. Ethnopharmacol;107(2):229- 33.
- Tang, H.Q., Hu, J., Yang, L., Tan, R.X..(2000). “Terpenoids and flavonoids from Artemisia species”.Planta Med.;66(4):391- 3.
- Haejin, K., Jin- Mu, Y., No, S. K., You, J. L., Jinhee, K., Dal- Seok, O., Se- Mi, O., Ok- Sun, B., Jun, L..(2012). “Cytotoxic compounds from the fruits of Vitex rotundifoliaagainst human cancer cell lines”.Journal of the Korean Society for Applied Biological Chemistry; 55:3: 433–437.
- Judith, B. O., Prey, P.R. H..(2003). “Enhanced sensitivity of human oral tumours to the flavonol, morin, during cancer progression: involvement of the Akt and stress kinase pathways”. Carcinogenesis; 24: 2: 171–177.
- Kriplani, P., Guarve, K., Baghael, U.S.. (2017). “Arnica montana L.- a plant of healing: review”. Pharm Pharmacol;69(8):925- 945.
- Iwase, Y., Takemura, Y., Ju- ichi, M., Mukainaka, T., Ichiishi, E., Ito, C., Furukawa, H., Yano, M., Tokuda, H., Nishino, H..(2001). “Inhibitory effect of flavonoid derivatives on Epstein- Barr virus activation and two- stage carcinogenesis of skin tumors”.Cancer Lett.;173(2):105- 9.
- Mingshan, J., Yaping, L., Zumin, G., Xiuwei, L..(2015). “Inhibitory Effects of Amorphigenin on the Mitochondrial Complex I of Culex pipiens pallens Coquillett (Diptera: Culicidae)”. J. Mol. Sci.; 16(8): 19713–19727.
- Ola, B., Olov, S..(2006). “Spasmolytic Flavonols from Artemisia abrotanum“. Georg Thieme Verlag Stuttgart ; New York, DOI: 10.1055/s- 2006- 958106.
- Mata, R., Rojas, A. , Acevedo, L., Estrada, S. , Calzada, F., Rojas, I. , Bye, R. , Linares, E..(2006). “Smooth Muscle Relaxing Flavonoids and Terpenoids from Conyza filaginoides”.Georg Thieme Verlag Stuttgart; New York, DOI: 10.1055/s- 2006- 957598.
- Atta, A.H., Mouneir, S.M..(2005). “Evaluation of some medicinal plant extracts for antidiarrhoeal activity”.Phytother Res.;19(6):481- 5.
- Hasrat, J.A., Pieters, L., Claeys, M., Vlietinck, A. (1997). “Adenosoine- l- active ligands: Cirsimaritin. A flavone glycoside from Micro tea debilis”. Journal of Natural products; 60: 638- 641.
- 34) Xu, L., Zhao, Y., Qin, Y., Xu, Q…(2006). “A novel model of acute liver injury in mice induced by T cell- mediated immune response to lactosylated bovine serum albumin”. Exp. Immunol.; 144(1): 125–133.
- Chen, L., Yin, Y., Yi, H., Xu, Q., Chen, T..(2007). “Simultaneous quantification of five major bioactive flavonoids in Rhizoma smilacis glabrae by high- performance liquid chromatography”. Pharm Biomed Anal.;43(5):1715- 20.
- Sittiwet, C., Puangpronpitag, D..(2009). “Antimicrobial Properties of Derris scandens Aqueous Extract”. Journal of Biological Sciences; 9: 6: 607- 611.
- Przegaliński, E., Tatarczyńska, E., Chojnacka- Wójcik, E.,(2000). “The influence of the benzodiazepine receptor antagonist flumazenil on the anxiolytic- like effects of CGP 37849 and ACPC in rats”. Neuropharmacology;39(10):1858- 64.
- Liu, Z., Lindemeyer, A.K., Liang, J., Wallner, M., Shao, X.M., Shao, Y., Tao, Y., Olsen, R.W..(2018). “Flavonoids isolated from Tibetan medicines, binding to GABAAreceptor and the anticonvulsant activity”.Phytomedicine ;50:1- 7.
- Viola, H., Wasowski, C., Levi de Stein, M., Wolfman, C., Silveira, R., Dajas, F., Medina, J.H., Paladini, A.C., (2006). “Apigenin, a component of Matricaria recutita flowers, is a central benzodiazepine receptors- ligand with anxiolytic effects”. Georg Thieme Verlag Stuttgart ; New York ,DOI: 10.1055/s- 2006- 958058.
- Viswanathan, S., Thirugnanasambantham, P., Reddy, M.K., Kameswaran, L., (1984). “Gossypetin- induced analgesia in mice”. European Journal of Pharmacology; 98: 289±291.
- Viswanathan, S., (1984). “Pharmacological investigation on certain bioflavonoids”. PhD Thesis, University of Madras, India.
- Thirugnananasamambantham, P., Viswanthan, S., Reddy, M.K., Ramachandran, S., Kameswaran, L., (1985). “Analgaeis activity of certain bioflavonoids”. Indian Journal of Pharmaceutical Sciences; 47: 230- 231.
- Shanmugasundaram, J., Subramanian, V., Nadipelly, J.S., Kathirvelu, P., Sayeli, V., Cheriyan, B.V..(2018).”Sedative–hypnotic like effect of 5–methoxyflavone in mice and investigation on possible mechanisms by in vivo and in silico methods”. Biomedicine & Pharmacotherapy; 08.117.
- Mueller, M.S., Karhagomba, I.B., Hirt, H.M., Wemakor, E..(2001). “The potential of Artemisia annua L. as a locally produced remedy for malaria in the tropics: Agricultural, chemical and clinical aspects”. Journal of Ethnopharmacology; 73(3):487- 93
- Eric, Y., ND, R.H..(2015). “Synergy in Herbal Medicines: Part 1”. Restorative Medicine;4:1:60- 73
- Nkunka, M.H.H., (1992). “Progress in the search for antimalarils”. Addis Ababa University, NAPRECA Monography Series No. 4, Ethiopia; pp. 1- 36.
- Harborne, J.B., Williams, C.A..(2000). “Advances in flavonoid research since 1992”.Phytochemistry;55(6):481- 504.
- Hertog, M.G.L., Hollmann, P.C.H., Katan, M.B., (1992). “Content of anticarcinogenic flavonoids in 28 vegetables and 9 fruits commonly consumed”. Journal of agriculture and food chemistry; 40: 2379- 2383.
- Mark, M..(2016). “Soy and Health Update: Evaluation of the Clinical and Epidemiologic Literature”.Nutrients; 8(12): 754.
- Yang, C.S., Wang, H., (2011).”Mechanistic issues concerning cancer prevention by tea Catechins”. Mol. Nutr. Food Res.; 55(6): 819–31.
- Jankun, J., Selman. S.H., Sweieroz, R., Jankun, E.S., (1997). “why drinking green tea could prevent cancer”. Nature; 387- 561.
- Orner, G.A., Dashwood, W.M., Blum, C.A., Diaz, G.D., Li Q., Dashwood, R.H.,(2003). “Suppression of tumorigenesis in the Apc(min) mouse: down- regulation of betacatenin signaling by a combination of tea plus sulindac”. Carcinogenesis; 24(2):263–7.
- Cao, Y., Cao, R., (1999). “Angiogenesis inhibited by drinking tea”. Nature; 398- 381.
- Whitsett, T., Carpenter, M., Lamartiniere, C.A.,(2006). “Resveratrol, but not EGCG, in the diet suppresses DMBA- induced mammary cancer in rats”. J Carcinog; 15:5–15.
- Kim, M., Murakami, A., Miyamoto, S., Tanaka, T., Ohigashi, H., (2010). “The modifying effects of green tea polyphenols on acute colitis and inflammation- associated colon carcinogenesis in male ICR mice”. Biofactors; 36(1):43–51.
- US Department of Agriculture, Agricultural Research Service, (2007). USDA Database for the Flavonoid Content of Selected Foods, Release 2.1. Nutrient Data Laboratory Home Page, (2012). Accessed at http://www.ars.usda.gov/nutrientdata on 17 June.
- Boehm, K., Borrellim F., Ernstm E., Habacherm G., Hung, S.K., Milazzo, S., et al., (2009). “Green tea(Camellia sinensis) for the prevention of cancer”. Cochrane Database Syst Rev.; (3):CD005004.
- Zheng, J., Yang, B., Huang, T., Yu, Y., Yang, J., Li, D., (2011). “Green tea and black tea consumption and prostate cancer risk: an exploratory meta- analysis of observational studies”. Nutr Cancer; 63(5):663–72.
- Sun, C.L., Yuan, J.M., Koh, W.P., Yu, M.C., (2006). “Green tea, black tea and breast cancer risk: a meta- analysis of epidemiological studies”. Carcinogenesis; 27(7):1310–5.
- Seely, D., Mills, E.J., Wu, P., Verma, S., Guyatt, G.H., (2005). “The effects of green tea consumption on incidence of breast cancer and recurrence of breast cancer: a systematic review and meta- analysis”. Integr Cancer Ther; 4(2):144–55.
- Tang, N., Wu, Y., Zhou, B., Wang, B., Yu, R., (2009). “Green tea, black tea consumption and risk of lung cancer: a meta- analysis”. Lung Cancer; 65(3):274–83.
- Nagle, C.M., Olsen, C.M., Bain, C.J., Whiteman, D.C., Green, A.C., Webb, P.M., (2010). “Tea consumption and risk of ovarian cancer”. Cancer Causes Control; 21(9): 1485–91.
- Butler, L.M., Wu, A.H., (2011). “Green and black tea in relation to gynecologic cancers”. Mol Nutr Food Res; 55(6):931–40.
- Sing, M.F., Yang, W.S., Gao, S., Gao, J., Xiang, Y.B., (2011). “Epidemiological studies of the association between tea drinking and primary liver cancer: a meta- analysis”. Eur J Cancer Prev; 20(3):157–65.
- Kang, H., Rha, S.Y., Oh, K.W., Nam, C.M., (2010). “Green tea consumption and stomach cancer risk: a meta- analysis”. Epidemiol Health; 26;32:e2010001.
- Braem, M.G., Onland- Moret, N.C., Schouten, L.J., Tjonneland, A., Hansen, L., Dahm, C.C., et al., (2012). “Coffee and tea consumption and the risk of ovarian cancer: a prospective cohort study and updated meta- analysis”. Am J Clin Nutr. 95(5):1172–81.
- Zhou, B., Yang, L., Wang, L., Shi, Y., Zhu, H., Tang, N., Wang, B., (2007). “The association of tea consumption with ovarian cancer risk: a metaanalysis”. Am J Obstet Gynecol; 197(6):594.e1–6.
- Steevens, J., Schouten, L.J., Verhage, B.A., Goldbohm, R.A., van den Brandt, P.A., (2007). “Tea and coffee drinking and ovarian cancer risk: results from the Netherlands Cohort Study and a meta- analysis”. Br J Cancer; 5;97(9):1291–4.
- Zhou, Y., Li, N., Zhuang, W., Liu, G., Wu, T., Yao, X., et al., (2008). “Green tea and gastric cancer risk: meta- analysis of epidemiologic studies”. Asia Pac J Clin Nutr; 17(1):159–65.
- Myung, S.K., Bae, W.K., Oh, S.M., Kim, Y., Ju, W., Sung, J., et al., (2009). “Green tea consumption and risk of stomach cancer: a meta- analysis of epidemiologic studies”. Int J Cancer; 1;124(3):670–7. Erratum in, (2009). Int J Cancer; 15;124(6):1496.
- Sun, C.L., Yuan, J.M., Koh, W.P., Yu, M.C.,(2006). “Green tea, black tea and colorectal cancer risk: a meta- analysis of epidemiologic studies”. Carcinogenesis; 27(7): 1301–9.
- Tang, N.P., Li, H., Qiu, Y.L., Zhou, G.M., Ma, J., (2009). “Tea consumption and risk of endometrial cancer: a metaanalysis”. Am J Obstet Gynecol; 201(6):605.e1–8.
- Hwang, Y.W., Kim, S.Y., Jee, S.H., Kim, Y.N., Nam, C.M., (2009). “Soy food consumption and risk of prostate cancer: a meta- analysis of observational studies”. Nutr Cancer; 61(5):598–606.
- Dong, J.Y., Qin, L.Q., (2011). “Soy isoflavones consumption and risk of breast cancer incidence or recurrence: a meta- analysis of prospective studies”. Breast Cancer Res Treat; 125(2):315–23.
- Hooper, L., Madhavan, G., Tice, J.A., Leinster, S.J., Cassidy, A., (2010). “Effects of isoflavones on breast density in pre- and post- menopausal women: a systematic review and meta- analysis of randomized controlled trials”. Hum Reprod Update; 16(6):745–60.
- Trock, B.J., Hilakivi- Clarke, L., Clarke, R., (2006). “Meta- analysis of soy intake and breast cancer risk”. J Natl Cancer Inst; 98(7):459–71
- Wu, A.H., Yu, M.C., Tseng, C.C., Pike, M.C., (2008). “Epidemiology of soy exposures and breast cancer risk”. Br J Cancer; 98(1):9–14.
- Tang, N.P., Zhou, B., Wang, B., Yu, R.B., Ma, J., (2009). “Flavonoids intake and risk of lung cancer: a meta- analysis”. Jpn J Clin Oncol; 39(6):352–9.